रेडियोधर्मिता (Radioactivity)
इस लेख में, हम रेडियोधर्मिता (Radioactivity) की घटना के बारे में अध्ययन करने जा रहे हैं, जो कुछ भारी तत्वों से संबंधित है।
 Table of Contents
Table of Contents- रेडियोधर्मिता क्या होती है?
- रेडियोधर्मी तत्वों के प्रकार
- रेडियोधर्मी क्षय के प्रकार
- रेडियोधर्मी किरणों के गुण
- रेडियोधर्मी क्षय के गुण
- रेडियोधर्मी क्षय का मापन
- रेडियोधर्मी तत्वों के अनुप्रयोग
रेडियोधर्मिता क्या होती है?
कुछ तत्व (और उनके यौगिक) स्थिर नहीं होते हैं। वे कुछ मूलकणों या विकिरण (जिन्हें रेडियोधर्मी किरणें कहा जाता है) का उत्सर्जन करके स्वयं विघटित हो जाते हैं। ऐसे तत्वों को रेडियोधर्मी पदार्थ (radioactive substances) कहा जाता है और इस घटना को रेडियोधर्मिता (radioactivity) कहा जाता है।
दूसरे शब्दों में, ऐसे रेडियोधर्मी तत्वों का नाभिक स्थिर नहीं होता है और यह रेडियोधर्मी किरणों का उत्सर्जन करके स्थिर अवस्था में पहुँचने का प्रयास करता है। यह अस्थिरता परमाणु के नाभिक में न्यूट्रॉन की अधिक मात्रा के कारण होती है।
तो, रेडियोधर्मिता परमाणु की नाभिकीय अस्थिरता के कारण होती है। यह एक परमाणु के नाभिक से संबंधित घटना है, यानी यह एक नाभिकीय घटना है।
 रेडियोधर्मिता की खोज
रेडियोधर्मिता की खोजरेडियोधर्मिता की खोज गलती से 1896 में ए. एच. बेकरेल (A. H. Becquerel) द्वारा की गई थी, जब वे दृश्य प्रकाश से विकिरणित यौगिकों के प्रतिदीप्ति (fluorescence) और स्फुरदीप्ति (phosphorescence) का अध्ययन कर रहे थे।
बाद में मैडम क्यूरी (Madam Curie) ने थोरियम/thorium (और इसके यौगिकों) में रेडियोधर्मिता की घटना का पता लगाया। उन्होंने अपने पति पिरे क्यूरी (Pirre Curie) के साथ मिलकर यह भी पाया कि रेडियम (radium) भी रेडियोधर्मी होता है।
 प्रतिदीप्ति और फॉस्फोरेसेंस
प्रतिदीप्ति और फॉस्फोरेसेंसप्रतिदीप्ति (Fluorescence): कुछ पदार्थों के परमाणु उच्च आवृत्ति (अर्थात कम तरंग दैर्ध्य) के फोटॉन को अवशोषित करते हैं और उच्च ऊर्जा अवस्था में चले जाते हैं। हालाँकि, ये उच्च ऊर्जा अवस्थाएँ अस्थिर होती हैं और इसलिए जल्द ही वे कम आवृत्ति (यानी उच्च तरंग दैर्ध्य) के फोटॉन (यानी प्रकाश) का उत्सर्जन करते हैं और अपनी मूल स्थिति में वापस आ जाते हैं।
इसलिए प्रतिदीप्ति पदार्थ, प्रकाश स्रोत की उपस्थिति में ही प्रकाश उत्सर्जित करते हैं। जैसे ही प्रकाश स्रोत (अर्थात आपतित विकिरण) को बंद कर दिया जाता है, प्रतिदीप्ति पदार्थों द्वारा प्रकाश का उत्सर्जन बंद हो जाता है।
प्रकाश के उत्सर्जन की इस घटना को प्रतिदीप्ति कहा जाता है, और ऐसे पदार्थों को प्रतिदीप्ति पदार्थ कहा जाता है।
प्रतिदीप्ति पदार्थों के कुछ उदाहरण हैं:
- यूरेनियम ऑक्साइड (Uranium oxide)
- बेरियम प्लैटिनोसाइनाइड (Barium platinocyanide) - इसका उपयोग एक्स-रे की खोज में किया जाता है।
- ट्यूब लाइट भी इस घटना का उपयोग करती है।
फॉस्फोरेसेंस (Phosphorescence): यह घटना कुछ हद तक प्रतिदीप्ति के समान है। हालांकि, आपतित प्रकाश को हटा देने के बाद भी फॉस्फोरेसेंस पदार्थ प्रकाश उत्सर्जित करना जारी रख सकते हैं।
फॉस्फोरेसेंस पदार्थों के कुछ उदाहरण हैं:
जिंक सल्फाइड (Zinc sulphide)
कैल्शियम सल्फाइड (Calcium sulphide)
बेरियम सल्फाइड (Barium sulphide)
फॉस्फोरसेंट पदार्थों का लेमिनेशन अक्सर घड़ियों की सुई पर और विभिन्न होर्डिंग बोर्ड (विपणन और विज्ञापनों के लिए) में किया जाता है। उन पर मौजूद फॉस्फोरसेंट पदार्थ दिन में सूर्य के प्रकाश को अवशोषित करते हैं और रात में प्रकाश उत्सर्जित करते हैं।
रेडियोधर्मी तत्वों के प्रकार
रेडियोधर्मी तत्व दो प्रकार के होते हैं:
प्राकृतिक रेडियोधर्मी तत्व (Natural Radioactive Elements): ये वह रेडियोधर्मी तत्व हैं जो स्वाभाविक रूप से रेडियोधर्मिता की घटना को प्रदर्शित करते हैं। यानी ये प्रकृति में पाए जाते हैं। उदाहरण के लिए, यूरेनियम (U92), रेडियम (Ra88), थोरियम (Th90), आदि।
कृत्रिम रेडियोधर्मी तत्व (Artificial Radioactive Elements): ये वे रेडियोधर्मी तत्व हैं जो प्रकृति में नहीं पाए जाते हैं। बल्कि, ये सिंथेटिक रेडियोधर्मी तत्व हैं - इन्हें कृत्रिम रूपांतरण द्वारा प्रयोगशालाओं में बनाया जाता है। यूरेनियम के बाद के सभी तत्वों को कृत्रिम रूपान्तरण द्वारा तैयार किया गया है। उदाहरण के लिए, Np
+ → +
रेडियोधर्मी क्षय के प्रकार
हम पहले से ही जानते हैं कि रेडियोधर्मिता एक नाभिकीय घटना है जिसमें एक अस्थिर नाभिक का क्षय होता है। इसे रेडियोधर्मी क्षय (Radioactive Decay) कहते हैं।
रेडियोधर्मी क्षय तीन प्रकार का होता है।
α-क्षय
इसमें, एक α-कण (अर्थात हीलियम नाभिक) नाभिक द्वारा उत्सर्जित होता है।
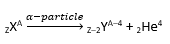
जब ऐसा होता है, तो परमाणु क्रमांक (atomic number) 2 से घट जाता है और द्रव्यमान संख्या (mass number) 4 से घट जाती है।
β-क्षय
इसमें, नाभिक द्वारा इलेक्ट्रॉन या पॉज़िट्रॉन उत्सर्जित होते हैं। पॉज़िट्रॉन वे कण होते हैं जिनका द्रव्यमान इलेक्ट्रॉनों के समान होता है, लेकिन उनका आवेश इलेक्ट्रॉन के बिल्कुल विपरीत होता है।
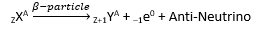
जब ऐसा होता है, तो परमाणु क्रमांक 1 से बढ़ जाता है, पर द्रव्यमान संख्या अपरिवर्तित रहती है।
उच्च n:p अनुपात वाले नाभिक (अर्थात जिनमें अतिरिक्त न्यूट्रॉन होते हैं) β उत्सर्जन द्वारा क्षय होते पाए जाते हैं।
γ-क्षय
इसमें, γ-किरणें (अर्थात सैकड़ों keV या अधिक के उच्च ऊर्जा वाले फोटॉन) नाभिक द्वारा उत्सर्जित होते हैं।
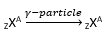
जब ऐसा होता है, तो परमाणु क्रमांक और द्रव्यमान संख्या अपरिवर्तित रहती हैं।
रेडियोधर्मी किरणों के गुण
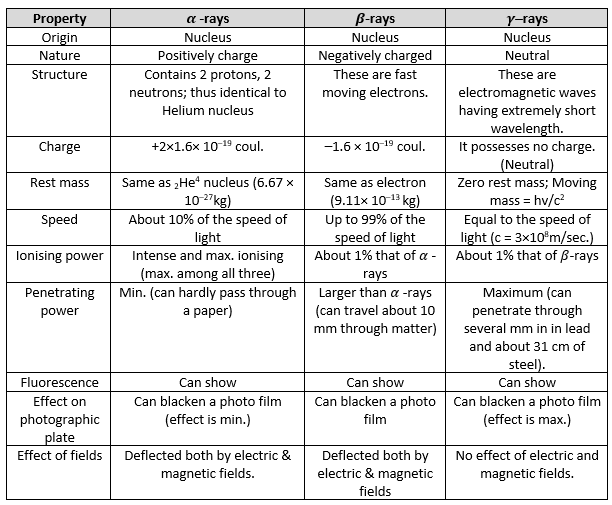
अब, आइए रेडियोधर्मी किरणों, यानी α, β और γ-किरणों के गुणों पर एक नज़र डालें।
रेडियोधर्मी क्षय के गुण
रेडियोधर्मी तत्व α-कणों और β-कणों का एक साथ उत्सर्जन नहीं करते हैं। वे या तो α-कण या β-कण उत्सर्जित करेंगे, लेकिन एक ही समय में दोनों एक साथ नहीं। हालांकि, वे α- और β-कणों के साथ γ-किरणों का उत्सर्जन कर सकते हैं।
यह भी ध्यान दें कि, किसी दिए गए रेडियोधर्मी नमूने में प्रति इकाई समय में क्षय होने वाले नाभिकों की संख्या (चाहे वह किसी भी प्रकार का क्षय हो: α, β या γ-क्षय), उस नमूने में नाभिक की कुल संख्या के समानुपाती होती है।
रेडियोधर्मी क्षय के संबंध में एक सिद्धांत भी है। इसे रेडियोधर्मी विघटन का रदरफोर्ड-सोडी सिद्धांत (Rutherford-Soddy theory) कहा जाता है। यह रेडियोधर्मी क्षय के संबंध में निम्नलिखित नियम बताता है:
- रेडियोधर्मी क्षय एक यादृच्छिक प्रक्रिया (random process) है। हम यह अनुमान नहीं लगा सकते कि कौन सा परमाणु पहले विघटित होगा - यह केवल संयोग की बात है।
- रेडियोधर्मी क्षय भौतिक स्थितियों पर निर्भर नहीं करता है, उदा. दबाव, तापमान आदि। यानी रेडियोधर्मी उत्सर्जन एक स्वतःस्फूर्त प्रक्रिया (spontaneous process) है। हम भौतिक स्थितियों को बदलकर इसे तेज या धीमा नहीं कर सकते।
- रेडियोधर्मी क्षय एक समस्थानिक (isotope) से दूसरे में भिन्न होता है, अर्थात एक ही तत्व के विभिन्न समस्थानिक उनके रेडियोधर्मी उत्सर्जन में भिन्न हो सकते हैं। तो, रेडियोधर्मी क्षय समस्थानिक की विशेषता है, न कि तत्व की।
रेडियोधर्मी क्षय का मापन
हम रेडियोधर्मी क्षय को मापने के लिए, और विभिन्न रेडियोधर्मी पदार्थों की रेडियोधर्मिता की तुलना करने के लिए कुछ अवधारणाओं का उपयोग करते हैं। ये नीचे दी गयी हैं।
गतिविधि (Activity)
रेडियोधर्मी पदार्थ के नमूने में रेडियोधर्मी नाभिक की संख्या को मापना संभव नहीं है। हालाँकि, हम एक नमूने की क्षय दर को आसानी से माप सकते हैं। इसे उस रेडियोधर्मी पदार्थ की गतिविधि (Activity of that radioactive substance) कहते हैं।
कुछ बहुत प्रसिद्ध इकाइयाँ हैं जिनका उपयोग गतिविधि को मापने के लिए किया जाता है:
- गतिविधि के लिए SI इकाई बेकरेल (Becquerel, Bq) है। (रेडियोधर्मिता के खोजकर्ता हेनरी बेकरेल / Henry Becquerel के नाम पर रखा गया)। 1 Bq = प्रति सेकंड 1 विघटन या क्षय।
- हम गतिविधि को मापने के लिए क्यूरी (Curie, Ci) का भी उपयोग करते हैं। 1 Ci = 3.7 × 1010 क्षय प्रति सेकंड = 3.7 × 1010 Bq
- एक अन्य प्रसिद्ध इकाई रदरफोर्ड (Rutherford) है। 1 rutherford = प्रति सेकंड 106 क्षय = 106 Bq
अर्धायु काल (Half Life)
किसी रेडियोधर्मी तत्व का अर्धायु काल/हाफ लाइफ (T1/2) वह समय-अवधि है जिसमें उसके नमूने के आधे परमाणु क्षय हो जाते हैं।
 नोट
नोटऔसत जीवन (τ) = 1.44 × अर्धायु काल (T1/2)
विभिन्न रेडियोधर्मी परमाणुओं की गतिविधि दर अलग-अलग होती है, यानी वे क्षय की दर में बहुत भिन्न होते हैं। रेडियोधर्मी तत्व जिनका अर्धायु काल ब्रह्मांड की आयु (15 बिलियन वर्ष) से कम है, बहुत पहले ही ख़त्म हो चुके हैं। इसलिए, हम उन्हें प्रकृति में नहीं पाते हैं। उन्हें हमारी प्रयोगशालाओं में परमाणु प्रतिक्रियाओं में कृत्रिम रूप से उत्पादित किया जाता है। ऐसे अल्पकालिक रेडियोधर्मी तत्वों के कुछ उदाहरण ट्रिटियम (tritium), प्लूटोनियम (plutonium), आदि हैं।
रेडियोधर्मी तत्वों के अनुप्रयोग
अब, आइए रेडियोधर्मी पदार्थों के उपयोग के कुछ मामलों पर एक नजर डालते हैं।
परमाणु बम (Nuclear Bombs)
रेडियोधर्मी तत्वों का सबसे प्रसिद्ध उपयोग परमाणु बमों में है, उदा. विखंडन बम (fission bombs), संलयन बम (fusion bombs).
रेडियोधर्मी गणन (Radioactive Dating)
हम वस्तुओं, जीवाश्मों, हड्डियों, भूवैज्ञानिक घटनाओं, आदि की आयु का अनुमान लगाने में भी रेडियोधर्मिता की अवधारणा का उपयोग करते हैं। इस आयु अनुमान को रेडियोधर्मी गणन, रेडियोधर्मी डेटिंग, या रेडियो आइसोटोप डेटिंग कहा जाता है। इस उद्देश्य के लिए विभिन्न प्राकृतिक रूप से पाए जाने वाले रेडियोधर्मी समस्थानिकों का उपयोग किया जाता है।
रेडियोधर्मी तत्व समय के साथ क्षय होते हैं। तो, समय के साथ उनकी मात्रा किसी नमूने में घटती रहेगी। यह हमें उस नमूने की आयु का कुछ हद तक अनुमान लगाने में मदद करता है - चाहे वह चट्टान हो, मृत पौधे हों, जीव या जैव अवशेष, आदि। इस उद्देश्य के लिए नमूने में रेडियो आइसोटोप की मात्रा का पता लगाने की तकनीक को रेडियो आइसोटोप डेटिंग (radio isotope dating) कहा जाता है।
कार्बन गणन, रेडियोधर्मी गणन का सबसे आम और प्रसिद्ध रूप है। संयुक्त राज्य अमेरिका के प्रो. लिब्बी (Prof. Libby) इस विचार का सुझाव देने वाले पहले व्यक्ति थे। इसमें हम रेडियोधर्मी कार्बन समस्थानिक कार्बन-14 का उपयोग करते हैं।
कार्बन-14 रेडियोधर्मी गणन में इतना उपयोगी क्यों है?
- इसका अर्धायु काल 5600 वर्ष है, जो इसे रेडियोधर्मी गणन उद्देश्यों के लिए बहुत उपयोगी बनाता है।
- यह हमारे वातावरण में सामान्य कार्बन के साथ प्रचुर मात्रा में मौजूद होता है। तो, यह हमें किसी भी जीव या पौधे की उम्र का पता लगाने की अनुमति देता है जो हवा का सेवन करता है, जिसमें कार्बन-डाइ-ऑक्साइड होता है।
लेकिन यह कैसे किया जाता है?
- कार्बन-14 वायुमंडलीय कार्बन डाइऑक्साइड अणुओं में समाहित है।
- जब पौधे CO2 में सांस लेते हैं, तो वे इस रेडियोधर्मी कार्बन का भी सेवन करते हैं।
- जब शाकाहारी जानवर पौधों को खाते हैं, तो कार्बन-14 उनके अंदर भी प्रवेश कर जाता है।
समय के साथ सभी जीवित जीवों में की सांद्रता लगभग 15 क्षय/मिनट के संतुलन मान तक पहुँच जाती है। यह तब तक स्थिर रहती है जब तक कोई जीव जीवित रहता है और सांस लेता और खाता रहता है।
हालांकि, जैसे ही कोई जीव मरता है, वह वातावरण से लेना बंद कर देता है। इससे जीव में की सांद्रता समय के साथ घटती जाती है।
इसलिए, यदि हम किसी प्राचीन जीव में रेडियोधर्मी कार्बन () और सामान्य कार्बन () की सांद्रता के अनुपात को माप सकते हैं, तो हम उस समय का अनुमान लगा सकते हैं जब जीव की मृत्यु हुई थी।
 नोट
नोटहमारे वायुमंडल में विभिन्न प्रकार के तत्व और उनके समस्थानिक मौजूद हैं। इनमें से अधिकांश समस्थानिक स्थिर हैं, अर्थात गैर-रेडियोधर्मी। हालाँकि, जब कॉस्मिक किरणें इन समस्थानिकों से टकराती हैं, तो कई रेडियोधर्मी समस्थानिक उत्पन्न होते हैं। कार्बन-14 () ऐसा ही एक रेडियोधर्मी समस्थानिक है। यह तब उत्पन्न होता है जब वायुमंडलीय नाइट्रोजन पर उच्च ऊर्जा वाले न्यूट्रॉनों की बमबारी की जाती है।
+ → +
जाहिर है, रेडियोधर्मी कार्बन अस्थिर है। कार्बन -14 परमाणु β-कण उत्सर्जित करके क्षय हो जाता है, और नाइट्रोजन पैदा करता है।
 भूवैज्ञानिक गणन (Geological dating)
भूवैज्ञानिक गणन (Geological dating)भूवैज्ञानिक गणन के लिए, यानी चट्टानों और खनिजों की अनुमानित उम्र का पता लगाने और यहां तक कि पृथ्वी की उम्र का अनुमान लगाने के लिए, वैज्ञानिक रेडियोधर्मी यूरेनियम () का उपयोग करते हैं। इस तकनीक को यूरेनियम गणन (uranium dating) कहते हैं।
 न्यूट्रॉन सक्रियण विश्लेषण (Neutron activation analysis)
न्यूट्रॉन सक्रियण विश्लेषण (Neutron activation analysis)न्यूट्रॉन सक्रियण विश्लेषण एक तकनीक है जिसका उपयोग बहुत कम मात्रा में मौजूद तत्वों की सांद्रता को मापने के लिए किया जाता है। इस तकनीक में नमूना नष्ट नहीं होता है।
चिकित्सा उपयोग
रेडियोधर्मी तत्वों का उपयोग चिकित्सा विज्ञान में भी किया जाता है। सबसे प्रसिद्ध उपयोगों में से एक, कोबाल्ट-आइसोटोप () का उपयोग ट्यूमर की कैंसर कोशिकाओं के इलाज के लिए किया जाता है (उन्हें नष्ट करके)।
रेडियोधर्मी तत्वों के कुछ अन्य चिकित्सीय उपयोग हैं:
- रक्ताल्पता (anemia) का पता लगाने के लिए Re-59 का उपयोग किया जाता है। रेडियोधर्मी लोहे का उपयोग भी रक्ताल्पता (और कुपोषण के अन्य रोग), तपेदिक, आदि जैसी बीमारियों का पता लगाने के लिए किया जाता है।
- रेडियोधर्मी सोडियम (Radioactive sodium) का उपयोग रक्त परिसंचरण में दोष का पता लगाने के लिए किया जाता है।
- Se-79 का उपयोग अग्न्याशय ग्रंथि (pancreatic gland) में विकारों का पता लगाने के लिए किया जाता है।
- रेडियोधर्मी आयोडीन (Radioactive iodine), थायरॉयड ग्रंथि में विकारों का पता लगाने (और इलाज) के लिए प्रयोग किया जाता है।
- P-32 (रेडियोधर्मी फास्फोरस) का उपयोग हड्डियों के रोग और रक्त कैंसर (ल्यूकेमिया/Leukemia) को ठीक करने के लिए किया जाता है। इसका उपयोग पौधों के भीतर खनिज लवणों (जैसे फॉस्फोरस/phosphorus) के अवशोषण और परिवहन का अध्ययन करने के लिए भी किया जाता है।
रेडियोधर्मी तत्वों का उपयोग कई अन्य उद्देश्यों के लिए भी किया जाता है। आइए उनमें से कुछ को नीचे सूचीबद्ध करें।
- रेडियोधर्मी तत्वों का उपयोग ट्रेसिंग (tracing) उद्देश्यों के लिए किया जाता है। उदाहरण के लिए, दवाओं में शरीर में ट्यूमर का पता लगाने के लिए, या एक भूमिगत पाइप (पानी या तेल ले जाने वाली) में रिसाव का पता लगाने के लिए, आदि।
- रेडियोधर्मिता अक्सर पौधों और बीजों में उत्परिवर्तन (mutations) करती है। इससे नए और बेहतर पौधों का विकास हुआ है।
- वैज्ञानिकों ने रेडियोऐक्टिव समस्थानिकों (विकिरण समस्थानिक, रेडियो-आइसोटोप, radio-isotopes) की मदद से बेहतर और अधिक प्रभावी कीटनाशक भी विकसित कर लिए हैं।
