नाभिक - प्रोटॉन और न्यूट्रॉन
इस लेख में, हम परमाणु के नाभिक, उसके घटकों - प्रोटॉन और न्यूट्रॉन और उन्हें एक साथ रखने वाले बल पर ध्यान केंद्रित करेंगे।
 Table of Contents
Table of Contents- नाभिक क्या होता है?
- प्रोटॉन और परमाणु क्रमांक
- न्यूट्रॉन
- न्यूक्लाइड्स का संकेतन
- नाभिक की स्थिरता
- अन्य मूलकण
नाभिक क्या होता है?
नाभिक किसी परमाणु के केंद्र में होता है जिसके चारों ओर इलेक्ट्रॉन घूमते हैं। यह बहुत सघन होता है - किसी नाभिक का आयतन परमाणु के आयतन का लगभग 10-12 गुना होता है; परन्तु, परमाणु के द्रव्यमान का 99.9% से अधिक नाभिक के भीतर समाहित रहता है।
किसी नाभिक के दो प्रमुख घटक, अर्थात् नाभिक के अंदर पाए जाने वाले प्राथमिक कण प्रोटॉन और न्यूट्रॉन हैं। आइए इन मूलकणों के बारे में और अधिक विस्तार से अध्ययन करें।
प्रोटॉन और परमाणु क्रमांक
प्रोटॉन की खोज रदरफोर्ड (Rutherford) ने की थी। एक प्रयोग में, जब उन्होंने α कणों के साथ नाइट्रोजन नाभिक पर बमबारी की, तो प्रोटॉन उत्सर्जित हुए। संबंधित समीकरण नीचे दिया गया है:
\(N^{14}_{7}\) + \(He^{4}_{2}\) → \({O}^{17}_{8}\) + \(H^{1}_{1}\)
प्रोटॉन की विशेषताएं
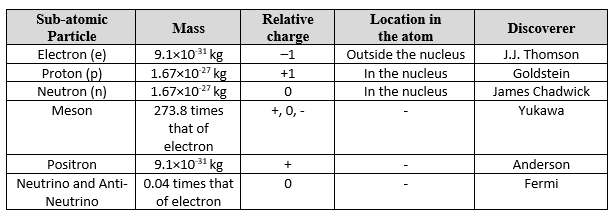
- प्रोटॉन पर आवेश मूल आवेश की एक इकाई जितना होता है, अर्थात + 1.6 x 10-19 कूलम्ब। यानी यह धनात्मक रूप से आवेशित है। वास्तव में, किसी भी परमाणु का नाभिक केवल प्रोटॉन के कारण धनावेशित होता है (क्योंकि न्यूट्रॉन आवेशहीन होते हैं)।
- एक प्रोटॉन का द्रव्यमान 1.672 x 10-27 किग्रा होता है।
परमाणु क्रमांक (Atomic Number)
हम जानते हैं कि एक इलेक्ट्रॉन (जो नाभिक के बाहर होता है) पर ऋणात्मक आवेश परिमाण में एक प्रोटॉन (जो नाभिक के अंदर होता है) पर धनात्मक आवेश के समान होता है। इसके अलावा, परमाणु विद्युत रूप से आवेशहीन होता है।
इसका अर्थ है कि परमाणु इलेक्ट्रॉनों का कुल आवेश (-Ze), परमाणु के नाभिक (+Ze) में प्रोटॉन के कुल आवेश के बराबर होता है। यह तभी संभव है जब किसी परमाणु में इलेक्ट्रॉनों की संख्या उसके नाभिक में प्रोटॉनों की संख्या के बराबर हो।
परमाणु का परमाणु क्रमांक (Z) = नाभिक में प्रोटॉन की संख्या = परमाणु में इलेक्ट्रॉनों की संख्या, अगर यह विद्युत रूप से आवेशहीन है
न्यूट्रॉन
समस्थानिकों (isotopes, आइसोटोप) का अध्ययन करते समय वैज्ञानिकों ने कई परिकल्पनाओं (hypotheses) को सामने रखा, जिनमें से एक ने सुझाव दिया कि नाभिक में कुछ आवेशहीन कण हो सकते हैं जो समस्थानिकों के विभिन्न परमाणु द्रव्यमान के लिए जिम्मेदार हो सकते हैं। (हम जल्द ही समस्थानिकों और परमाणु द्रव्यमान/Atomic Mass के बारे में अध्ययन करेंगे)
1932 में, जेम्स चैडविक (Chadwick) ने इस परिकल्पना की पुष्टि की। उन्होंने अल्फा-कणों के साथ बेरिलियम (beryllium) नाभिक पर बमबारी की, और देखा कि कुछ आवेशहीन विकिरण उत्सर्जित हुए।
\(Be^{9}_{4}\) + \(He^{4}_{2}\) → \({C}^{12}_{6}\) + \(n^{1}_{0}\)
यह तटस्थ विकिरण वास्तव में न्यूट्रॉन था। न्यूट्रॉन की खोज के लिए उन्हें 1935 में भौतिकी के नोबेल पुरस्कार से सम्मानित किया गया था।
न्यूट्रॉन की विशेषताएं
- न्यूट्रॉन विद्युत रूप से उदासीन/आवेशहीन होता है।
- न्यूट्रॉन का द्रव्यमान 1.6749 x 10-27 किग्रा होता है।
- यद्यपि न्यूट्रॉन नाभिक के अंदर स्थिर होता है, एक मुक्त न्यूट्रॉन अस्थिर होता है (इसके विपरीत, मुक्त प्रोटॉन स्थिर होता है)। एक मुक्त न्यूट्रॉन का औसत जीवन लगभग 1000s होता है और यह तीन प्राथमिक कणों - एक प्रोटॉन, एक इलेक्ट्रॉन और एक एंटीन्यूट्रिनो (antineutrino) में विघटित हो जाता है।
परमाणु भार या परमाणु द्रव्यमान
परमाणु भार (Atomic Weight) या परमाणु द्रव्यमान (Atomic Mass) किसी नाभिक में प्रोटॉन और न्यूट्रॉन की कुल संख्या होता है। क्यूंकि हम अक्सर प्रोटॉन या न्यूट्रॉन के लिए एक सामान्य शब्द न्यूक्लियॉन (nucleon) का उपयोग करते हैं, हम यह भी कह सकते हैं कि किसी परमाणु का परमाणु द्रव्यमान उसके नाभिक में न्यूक्लियॉन की संख्या होता है। इसे A अक्षर से प्रदर्शित किया जाता है।
परमाणु द्रव्यमान/भार का एक अन्य गणितीय निरूपण इस प्रकार है:
परमाणु भार = किसी तत्व के एक परमाणु का भार / कार्बन (C-12) के एक परमाणु के भार का बारहवां भाग
परमाणु भार को सापेक्ष परमाणु द्रव्यमान (Relative Atomic Mass) भी कहा जाता है। मास स्पेक्ट्रोमीटर (Mass spectrometer) वह उपकरण है जिसका उपयोग हम परमाणु द्रव्यमान को सटीक रूप से मापने के लिए करते हैं।
एक ही तत्व के परमाणुओं के परमाणु द्रव्यमान का मापन कभी-कभी अलग-अलग मान देता है। इससे समस्थानिकों (Isotopes, आइसोटोप) के अस्तित्व का पता चला।
समस्थानिक
समस्थानिक (Isotope, आइसोटोप) एक ही तत्व की परमाणु प्रजातियां हैं जो द्रव्यमान में भिन्न होती हैं। तो, एक ही तत्व में विभिन्न प्रकार के परमाणु हो सकते हैं जो द्रव्यमान में भिन्न होते हैं।
उन सभी में प्रोटॉन की संख्या समान होती है (अर्थात उनका परमाणु क्रमांक समान होते हैं), और इसलिए उन सभी को तत्वों की आवर्त सारणी (periodic table of elements) में एक ही स्थान पर रखा जाता है। वास्तव में, आइसोटोप एक ग्रीक शब्द है जिसका अर्थ है “एक ही स्थान”।
समस्थानिकों के गुण
- किसी विशेष तत्व के सभी समस्थानिकों के रासायनिक गुण समान होते हैं। ऐसा इसलिए है, क्योंकि तत्वों के रासायनिक गुण उनकी इलेक्ट्रॉनिक संरचना पर निर्भर करते हैं, और सभी समस्थानिकों की इलेक्ट्रॉनिक संरचना समान होती है (प्रोटॉन की समान संख्या और इलेक्ट्रॉनों की समान संख्या)।
- हालाँकि, समस्थानिकों के भौतिक गुण भिन्न होते हैं।
- व्यावहारिक रूप से प्रत्येक तत्व में कई समस्थानिकों का मिश्रण होता है। तो, समस्थानिक/आइसोटोप बहुत आम होते हैं। यहां तक कि हाइड्रोजन, जो सबसे हल्का तत्व है, के भी तीन समस्थानिक हैं।
 हाइड्रोजन के समस्थानिक (Isotopes of Hydrogen)
हाइड्रोजन के समस्थानिक (Isotopes of Hydrogen)हाइड्रोजन तत्व के तीन समस्थानिक होते हैं:
हाइड्रोजन (Hydrogen): यह हाइड्रोजन के तीन समस्थानिकों में सबसे हल्का परमाणु है। ऐसा इसलिए है क्योंकि इसके नाभिक में केवल एक प्रोटॉन होता है और कोई न्यूट्रॉन नहीं होता है। यह सबसे अधिक पाया जाने वाला आइसोटोप है (99.985% की प्रचुरता).
ड्यूटेरियम (Deuterium): चूंकि यह हाइड्रोजन का एक समस्थानिक है, इसलिए इसके नाभिक में केवल एक प्रोटॉन होता है। लेकिन, इसके अलावा इसके नाभिक में एक न्यूट्रॉन भी होता है। तो, इसका परमाणु द्रव्यमान सामान्य हाइड्रोजन परमाणु से दोगुना होता है।
ट्रिटियम (Tritium): चूंकि यह हाइड्रोजन का एक समस्थानिक है, इसलिए इसके नाभिक में केवल एक प्रोटॉन होता है। लेकिन, इसके अलावा इसके नाभिक में दो न्यूट्रॉन भी होते हैं। तो, इसका परमाणु द्रव्यमान सामान्य हाइड्रोजन परमाणु की तुलना में तीन गुना होता है। इसका नाभिक (nucleus) अस्थिर है और इसलिए यह प्रकृति में नहीं पाया जाता है। यह कृत्रिम रूप से प्रयोगशालाओं में निर्मित होता है।
 नोट
नोटआवर्त सारणी के सभी तत्वों में से पोलोनियम (Polonium) के समस्थानिकों की संख्या सबसे अधिक है।
 समभारिक और समन्यूट्रॉनिक
समभारिक और समन्यूट्रॉनिकछात्र अक्सर समस्थानिक (आइसोटोप, Isotopes), समभारिक (आइसोबार, Isobars) और समन्यूट्रॉनिक (आइसोटोन, Isotones) के बीच भ्रमित होते हैं। तो आइए इन दोनों शब्दों को भी समझते हैं।
* समभारिक: समभारिक वो न्यूक्लाइड होते हैं जिनकी द्रव्यमान संख्या (mass number, A) समान होती है, लेकिन उनके परमाणु क्रमांक (atomic numbers, Z) अलग-अलग होते हैं। उदाहरण के लिए, \(H^{3}_{1}\) और \(He^{3}_{2}\) समभारिक हैं। इसी तरह, \(Na^{22}_{11}\), और \(Ne^{22}_{10}\) समभारिक हैं।
* समन्यूट्रॉनिक: समन्यूट्रॉनिक वे न्यूक्लाइड होते हैं जिनकी न्यूट्रॉन संख्या समान होती है, लेकिन उनके परमाणु क्रमांक (Z) और द्रव्यमान संख्याएँ (A) अलग-अलग होती हैं। उदाहरण के लिए, \(H^{3}_{1}\) और \(He^{4}_{2}\); \(C^{14}_{6}\) और \(O^{16}_{8}\); फॉस्फोरस (\(P^{31}_{15}\)) और सिलिकॉन (\(Si^{30}_{14}\)) समन्यूट्रॉनिक हैं।
न्यूक्लाइड्स का संकेतन (Notation of Nuclides)
तो, हम जानते हैं कि विभिन्न तत्वों के नाभिक में विभिन्न प्रोटॉन और न्यूट्रॉन होते हैं। यहां तक कि एक ही तत्व के नाभिक में भी अलग-अलग संख्या में न्यूट्रॉन हो सकते हैं।
एक नाभिक की संरचना को प्रदर्शित करने के लिए हम निम्नलिखित शब्दों और प्रतीकों का उपयोग करते हैं:
Z - यह परमाणु क्रमांक अर्थात प्रोटॉनों की संख्या को दर्शाता है।
N - यह न्यूट्रॉन की संख्या का प्रतिनिधित्व करता है।
A - यह द्रव्यमान संख्या का प्रतिनिधित्व करता है, यानी प्रोटॉन और न्यूट्रॉन की कुल संख्या। तो, A = Z + N
न्यूक्लाइड्स को \(X^{A}_{Z}\) द्वारा दर्शाया जाता है, जहां X तत्वों का रासायनिक प्रतीक है।
उदाहरण के लिए, सोने का रासायनिक प्रतीक Au है। इसमें 79 प्रोटॉन और 118 न्यूट्रॉन होते हैं। इसका मतलब है कि इसमें 79 + 18 = 197 न्यूक्लियॉन होते हैं। तो, सोने के नाभिक को \(Au^{197}_{79}\) से निरूपित किया जाता है।
नाभिक की स्थिरता (Stability of Nucleus)
हम जानते हैं कि परमाणु का नाभिक स्थिर होता है। लेकिन ऐसा कैसे?
कौन सा बल प्रोटॉनों को एक साथ इतने निकट से बांधे रखता है?
प्रोटॉन एक दूसरे को प्रतिकर्षित क्यों नहीं करते, क्योंकि उन सभी पर धनात्मक आवेश होता है?
खैर, इन सवालों के जवाब जानने के लिए हमें कुछ अवधारणाओं, जैसे द्रव्यमान-ऊर्जा संबंध (mass-energy relation), द्रव्यमान क्षति (mass defect), आदि को समझने की जरूरत है।
द्रव्यमान क्षति, परमाणु बंधन ऊर्जा और प्रबल नाभिकीय बल (Mass defect, Nuclear Binding energy and Strong Nuclear force)
जब प्रोटॉन और न्यूट्रॉन एक साथ मिलकर कोई नाभिक बनाते हैं, तो कुछ द्रव्यमान खो जाता है। इस घटना को द्रव्यमान क्षति (Mass defect, मास डिफेक्ट) कहा जाता है।
तो, द्रव्यमान क्षति = मुक्त अवस्था में प्रोटॉन और न्यूट्रॉन के द्रव्यमान का योग - नाभिक का द्रव्यमान
यह लापता द्रव्यमान, यानी द्रव्यमान क्षति (∆m), नाभिक के बनने पर ऊर्जा (∆E) के रूप में निकलती है।
आइंस्टीन के द्रव्यमान ऊर्जा समतुल्य संबंध (Einstein’s mass energy equivalent relation) के अनुसार, E = mc2, जहाँ c प्रकाश की गति है।
 द्रव्यमान-ऊर्जा संबंध (Mass-Energy Relation)
द्रव्यमान-ऊर्जा संबंध (Mass-Energy Relation)आइंस्टीन के विशेष सापेक्षता के सिद्धांत (Einstein’s theory of special relativity) के अनुसार, द्रव्यमान और ऊर्जा समान हैं, अर्थात द्रव्यमान ऊर्जा का दूसरा रूप है। हम द्रव्यमान को ऊर्जा में बदल सकते हैं (जैसे ऊष्मा और गतिज ऊर्जा), और इसके विपरीत भी।
आइंस्टीन ने प्रसिद्ध द्रव्यमान-ऊर्जा तुल्यता संबंध, E = mc2 भी दिया। यह शायद भौतिकी में सबसे प्रसिद्ध समीकरण है। यहाँ, E द्रव्यमान m के समतुल्य ऊर्जा है, और c निर्वात में प्रकाश का वेग है (लगभग 3 × 108 m/s).
उत्सर्जित ऊर्जा समकक्ष (∆E) को नाभिक की बंधन ऊर्जा, या नाभिकीय बंधन ऊर्जा (Nuclear Binding energy) कहा जाता है। यह वह ऊर्जा है जिसे नाभिक को उसके घटक कणों में तोड़ने के लिए आपूर्ति की जानी चाहिए। औसत द्रव्यमान वाले नाभिक के लिए प्रति न्यूक्लियॉन बाध्यकारी ऊर्जा लगभग 8 MeV होती है। यह ऊर्जा परमाणुओं की बंधन ऊर्जा से बहुत अधिक होती है। इसका मतलब यह है कि एक नाभिक को एक साथ रखने वाला बल अलग-अलग परमाणुओं को एक साथ रखने वाले बल से बहुत अलग होता है। इस बल को प्रबल नाभिकीय बल (Strong Nuclear force) कहते हैं, जो प्रकृति की चार मूलभूत शक्तियों (four fundamental forces) में से एक है।
दूसरे शब्दों में, नाभिकीय बंधन ऊर्जा किसी परमाणु के नाभिक को एक साथ बांधने वाले प्रबल नाभिकीय बल को तोड़ने के लिए आवश्यक ऊर्जा है।
अब, आइए प्रबल नाभिकीय बल के कुछ प्रमुख गुणों पर एक नजर डालते हैं।
- यह एक प्रबल आकर्षक बल है जो सकारात्मक रूप से चार्ज किए गए प्रोटॉन (और न्यूट्रॉन) के बीच प्रतिकर्षण को दूर करने के लिए पर्याप्त रूप से प्रबल है, और उन्हें एक छोटे नाभिकीय आयतन में एक साथ पैक करता है। प्रबल नाभिकीय बल, विद्युत चुम्बकीय बल (या कूलम्ब बल) की तुलना में बहुत अधिक मजबूत होता है जो आवेशों के बीच कार्य करता है| यह होना ही है। आखिरकार, प्रबल नाभिकीय बल को एक कसकर भरे हुए नाभिक में प्रोटॉन के बीच मौजूद प्रतिकारक विद्युत चुम्बकीय बल पर हावी होना पड़ता है।
 नोट
नोटद्रव्यमान के बीच मौजूद गुरुत्वाकर्षण बल, विद्युत चुम्बकीय बल (या कूलम्ब बल) से भी कमजोर होता है।
- प्रबल नाभिकीय बल बहुत कम दूरी के लिए ही मजबूत रहता है। जैसे-जैसे दो न्यूक्लिऑन (nucleons) के बीच की दूरी कुछ फीमेलमीटर (femtometres) से अधिक हो जाती है, प्रबल नाभिकीय बल का परिमाण तेजी से शून्य हो जाता है।
- प्रबल नाभिकीय बल कणों पर मौजूद विद्युत आवेश से स्वतंत्र होता है। तो, न्यूट्रॉन-न्यूट्रॉन, प्रोटॉन-न्यूट्रॉन और प्रोटॉन-प्रोटॉन के बीच परमाणु बल लगभग समान होगा।
- हम किसी भी सरल गणितीय रूप में प्रबल नाभिकीय बल को निरूपित नहीं कर सकते (कम से कम अब तक)। (दूसरी ओर, कूलम्ब के नियम और न्यूटन के गुरुत्वाकर्षण के नियम को गणितीय रूप से दर्शाया जा सकता है)
संक्षेप में:
- प्रबल नाभिकीय बल और नाभिकीय बंधन ऊर्जा नाभिक की स्थिरता के मानदंड हैं। जितनी अधिक बंधन ऊर्जा होगी, नाभिक उतना ही अधिक स्थिर होगा, और इसके विपरीत भी सही है।
- इसका मतलब है कि जितना प्रबल नाभिकीय बल होगा, उतनी ही अधिक बंधन ऊर्जा होगी, और उतनी ही अधिक ऊर्जा होगी जो नाभिक को तोड़ने के लिए आवश्यक होगी।
- इसका मतलब है कि प्रबल नाभिकीय बल जितना कम होगा, बंधन ऊर्जा उतनी ही कम होगी, और नाभिक को तोड़ने के लिए आवश्यक ऊर्जा भी उतनी ही कम होगी।
अन्य मूलकण
हम पहले ही तीन मूलकणों - इलेक्ट्रॉन, प्रोटॉन और न्यूट्रॉन के बारे में पढ़ चुके हैं। अब, आइए कुछ अन्य प्रकार के मूलकणों पर एक नज़र डालें।
पॉज़िट्रॉन (Positron)
यह इलेक्ट्रॉन का प्रतिकण (antiparticle, एंटी-पार्टिकल) है। यह खोजा जाने वाला पहला प्रतिकण था। यह एंडरसन (Anderson) ने 1932 में खोजा था।
पॉज़िट्रॉन को धनात्मक इलेक्ट्रॉन भी कहा जाता है, क्योंकि:
- इसका द्रव्यमान एक इलेक्ट्रॉन के द्रव्यमान के समान होता है।
- इसका एक धनात्मक आवेश होता है जो एक इलेक्ट्रॉन के परिमाण के समान होता है।
एंटीप्रोटोन (Antiproton)
यह प्रोटॉन का प्रतिकण है।
- इसका द्रव्यमान प्रोटॉन के द्रव्यमान के समान होता है।
- इसका एक ऋणात्मक आवेश होता है जो एक प्रोटॉन के परिमाण के समान होता है।
- इसमें प्रोटॉन की तुलना में विपरीत दिशा में चुंबकीय आघूर्ण (oppositely directed magnetic moment) होता है।
 प्रतिकण (एंटी-पार्टिकल्स)
प्रतिकण (एंटी-पार्टिकल्स)प्रतिकणों के अस्तित्व की भविष्यवाणी फर्मी-डिराक के इलेक्ट्रॉन के सापेक्षतावादी क्वांटम सिद्धांत (Fermi-Dirac’s relativistic quantum theory of electron) द्वारा पहले ही कर दी गई थी।
कण और उसके प्रतिकण दोनों में होता है:
- बिल्कुल वही द्रव्यमान
- बिल्कुल वही स्पिन (spin)
- बिल्कुल वही जीवन काल (यदि वे अस्थिर हैं)
हालांकि, उनके पास होता है:
- विपरीत आवेश (यदि कोई हो)
- स्पिन और चुंबकीय आघूर्ण के बीच विपरीत संरेखण (opposite alignment between the spin and magnetic moment)
जब कोई कण अपने एंटी-पार्टिकल से मिलता है, तो वे परस्पर एक-दूसरे का विनाश कर देते हैं (अर्थात अपार ऊर्जा उत्पन्न करते हुए एक दूसरे को नष्ट कर देते हैं)।
न्यूट्रिनो और एंटी-न्यूट्रिनो (Neutrino and Anti-Neutrino)
पाउली (Pauli) ने 1930 में इन मूलकणों की खोज की थी।
- न्यूट्रिनो और एंटी-न्यूट्रिनो द्रव्यमान रहित होते हैं।
- न्यूट्रिनो और एंटी-न्यूट्रिनो आवेशहीन होते हैं।
- एंटी-न्यूट्रिनो (Anti-Neutrino) न्यूट्रिनो का प्रतिकण है। इसमें एंटी-स्पिन (anti-spin) होती है।
मेसॉन (Mesons)
- मेसॉन का द्रव्यमान इलेक्ट्रॉन और प्रोटॉन के बीच का होता है।
- मेसॉन उन पर स्तिथ आवेश के आधार पर तीन प्रकार के होते हैं: आवेशहीन, धनात्मक और नकारात्मक।
- सभी मेसॉन अस्थिर होते हैं।
क्वार्क और एंटी-क्वार्क (Quarks and Anti-Quarks)
क्वार्क वो मूलकण हैं जो पदार्थ के और भी अधिक मौलिक घटक हैं। वास्तव में, क्वार्क एक साथ मिलकर अन्य मिश्रित कण जैसे प्रोटॉन, न्यूट्रॉन बनाते हैं।
एंटी-क्वार्क, क्वार्क का प्रतिकण है।
बोसॉन (Bosons)
बोसॉन उप-परमाणु कण (subatomic particles) होते हैं जिनमें निम्नलिखित गुण होते हैं।
- बोसॉन में शून्य या समाकलन/integral स्पिन (spin) होती है।
- मेसॉन और फोटॉन मिलकर बोसोन बनाते हैं।
 नोट
नोटबोसॉन का नाम सत्येंद्र नाथ बोस (एक भारतीय वैज्ञानिक) के नाम पर रखा गया है।
अब, परमाणु में पाए जाने वाले विभिन्न मूलकणों के विवरण को संक्षेप में प्रस्तुत करते हैं।
 कॉस्मिक किरणें (Cosmic rays)
कॉस्मिक किरणें (Cosmic rays)कॉस्मिक किरणें मूल रूप से गहरे अंतरिक्ष से लगातार आने वाले उच्च ऊर्जा वाले परमाणु-नाभिक और मूलभूत कण हैं। दरअसल, हर सेकेंड में करीब 1018 कॉस्मिक किरणें पृथ्वी की सतह पर पहुंचती हैं।
इन कणों की ऊर्जा 109 से 1018 इलेक्ट्रॉन-वोल्ट तक हो सकती है (अर्थात ऊर्जा की एक विस्तृत श्रृंखला)। चूंकि उनमें उच्च ऊर्जा होती है, इसलिए ये ब्रह्मांडीय विकिरण अत्यधिक भेदनेवाले (penetrating) होते हैं।