परमाणु और अणु क्या होते हैं?
इस लेख में, हम परमाणु (atom) और अणु (molecule) की अवधारणा के बारे में जानेंगे।
 Table of Contents
Table of Contents- परमाणु क्या होता है?
- अणु क्या होते हैं?
- संयोजकता इलेक्ट्रॉनों की अवधारणा
परमाणु क्या होता है?
प्रत्येक पदार्थ या तत्व को छोटे और छोटे भागों में विभाजित किया जा सकता है। परमाणु किसी पदार्थ या तत्व का सबसे छोटा भाग है जो सभी भौतिक और रासायनिक गुणों को प्रदर्शित करता है। यदि हम किसी परमाणु को और अधिक विभाजित करते हैं, तो वह इन मूल गुणों को खो देगा।
हालांकि लंबे समय तक दार्शनिकों और वैज्ञानिकों ने परमाणु को पदार्थ का सबसे छोटा हिस्सा माना। उदाहरण के लिए, जॉन डाल्टन (John Dalton) के अनुसार, परमाणु अविभाज्य था। लेकिन बाद के प्रयोगों और अवलोकनों ने साबित कर दिया कि परमाणु और भी छोटे कणों से बने होते हैं, यानी परमाणु विभाज्य होते हैं।
 नोट
नोटयदि आप परमाणु की संरचना के विभिन्न मॉडलों का अध्ययन करना चाहते हैं, तो आप हमारे इस लेख को पढ़ सकते हैं।
अणु क्या होते हैं?
यद्यपि परमाणु तत्व का सबसे छोटा भाग है जो रासायनिक अभिक्रियाओं में भाग लेता है, लेकिन प्रकृति में यह स्वतंत्र अवस्था में नहीं होता है। प्रकृति में हमें ऐसे अणु मिलते हैं, जो दो या दो से अधिक परमाणुओं से बने होते हैं।
प्रकृति में आपको विभिन्न प्रकार के अणु मिलेंगे।
अणु की परमाणुता (Atomicity of a Molecule)
यह किसी पदार्थ के एक अणु में मौजूद परमाणुओं की संख्या है। उदाहरण के लिए:
- द्विपरमाणुक अणु (Diatomic molecules) - दो परमाणु वाले अणु, उदा. हाइड्रोजन (H2), नाइट्रोजन (N2), ऑक्सीजन (O2), आदि।
- त्रिपरमाण्विक अणु (Triatomic molecules) - तीन परमाणु वाले अणु, उदा. ओजोन (O3)।
- टेट्रा-परमाणु अणु (Tetra-atomic molecules) - चार परमाणु वाले अणु, उदा. फास्फोरस (P4), अमोनिया (NH3), आदि।
- और इस प्रकार आगे भी|
होमो-परमाणु और हेट्रो-परमाणु अणु
- होमो-परमाणु अणुओं (Homo-atomic molecules) में एक ही प्रकार के परमाणु होते हैं, उदा. H2, N2, O3, P4, आदि।
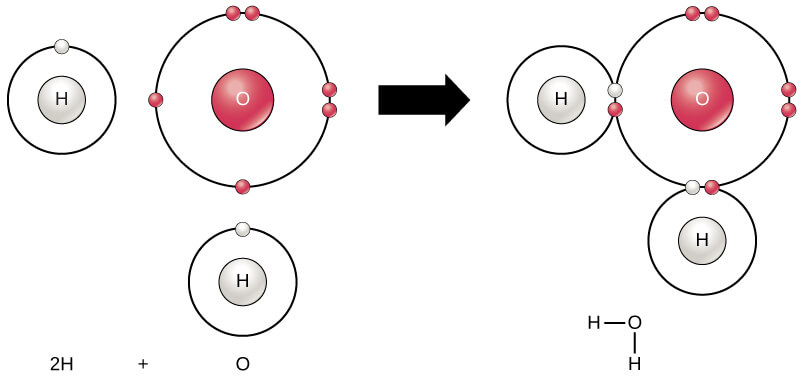
- हेट्रो-परमाणु अणुओं (Hetro-atomic molecules) में दो या दो से अधिक विभिन्न प्रकार के परमाणु होते हैं, उदा. अमोनिया (NH3) में एक नाइट्रोजन और तीन हाइड्रोजन परमाणु होते हैं; पानी (H2O) में दो हाइड्रोजन और एक ऑक्सीजन परमाणु होते हैं, आदि।
संयोजी इलेक्ट्रॉनों की अवधारणा
किसी परमाणु की सबसे बाहरी कक्षा में उपस्थित इलेक्ट्रॉन, संयोजी या संयोजकता इलेक्ट्रॉन (Valance Electrons) कहलाते हैं।
किसी तत्व के संयोजी इलेक्ट्रॉनों की संख्या आधुनिक आवर्त सारणी की समूह संख्या (group number) के बराबर होती है।
रासायनिक अभिक्रियाओं में केवल संयोजी इलेक्ट्रॉन भाग लेते हैं; आंतरिक कक्षाओं में रहने वाले इलेक्ट्रॉन नहीं। यही कारण है कि जिन तत्वों में संयोजी इलेक्ट्रॉनों की संख्या समान होती है, उनके रासायनिक गुण भी काफी हद तक समान ही होते हैं।