परमाणु की संरचना के विभिन्न मॉडल
इस लेख में, हम उन विभिन्न मॉडलों के बारे में जानने जा रहे हैं जो परमाणु की संरचना (structure of an atom) की व्याख्या करने के लिए प्रस्तावित किए गए थे।
समय के साथ आलोचकों ने किसी विशेष मॉडल में उपस्थित कमियों की ओर इशारा किया, जिसने सैद्धांतिक भौतिकविदों (theoretical physicists) को बेहतर स्पष्टीकरण या परिकल्पना के साथ आने के लिए मजबूर किया। यह प्रक्रिया लंबे समय तक दोहराई जाती रही, और अभी भी जारी है।
हालांकि पुराने समय के विपरीत, अब हमने शक्तिशाली इलेक्ट्रॉन सूक्ष्मदर्शी (electron microscopes) विकसित कर लिए हैं, जो हमें परमाणु की भी तस्वीरें लेने की अनुमति देते हैं। लेकिन फिर भी पदार्थ की वास्तविक प्रकृति हमारे लिए अभी भी एक पहेली है।
लेकिन, आइए पहले हम उन विभिन्न लोकप्रिय मॉडलों का अध्ययन करें जो परमाणु की संरचना की व्याख्या करने के लिए प्रस्तावित किए गए थे।
 Table of Contents
Table of Contents- थोड़ी पृष्ठभूमि
- थॉमसन का परमाणु मॉडल
- रटरफोर्ड का परमाणु मॉडल
- बोहर का परमाणु मॉडल
- क्वांटम यांत्रिकी मॉडल
थोड़ी पृष्ठभूमि
19वीं सदी की शुरुआत में वैज्ञानिकों को ये बातें पता थीं:
1897 में, अंग्रेजी भौतिक विज्ञानी जे जे थॉमसन, J. J. Thomson (1856-1940) ने पाया कि विभिन्न परमाणुओं में इलेक्ट्रॉन होते हैं जो नकारात्मक रूप से चार्ज होते हैं। लेकिन परमाणु समग्र रूप से आवेशहीन है। तो, एक परमाणु के अंदर कोई अन्य कण होना चाहिए जो घनात्मक रूप से आवेशित हो, और इलेक्ट्रॉनों के नकारात्मक आवेश को बेअसर कर सके। तो, उस समय के वैज्ञानिक परमाणु के अंदर घनात्मक कणों को खोजने की कोशिश कर रहे थे।
इलेक्ट्रॉन का द्रव्यमान पूरे परमाणु के द्रव्यमान से हजारों गुना हल्का पाया गया। इसलिए, वैज्ञानिकों को पता था कि परमाणु के अंदर अन्य कण भी होने चाहियें, जो एक इलेक्ट्रॉन की तुलना में बहुत भारी हों - ऐसा कुछ जो परमाणु को अपना अधिकांश द्रव्यमान देता है।
परमाणु की त्रिज्या 10-10 मीटर की कोटि की आंकी गई थी। (उन्होंने इस अनुमान तक पहुंचने के लिए पदार्थ के गतिज सिद्धांत, अर्थार्थ kinetic theory of matter का इस्तेमाल किया)।
एक बार जब यह स्पष्ट हो गया कि परमाणु और भी छोटे कणों (जैसे इलेक्ट्रॉन, आदि) से बने हैं, तो उन कणों को खोजने और समझाने की दौड़ शुरू हुई। और कई मॉडलों को यह समझाने के लिए प्रस्तावित किया गया कि वे परमाणु के अंदर कैसे व्यवस्थित हैं, यानी परमाणु कैसे संरचित होता है।
आइए, ऐसे ही कुछ प्रस्तावित मॉडलों का अध्ययन करें।
थॉमसन का परमाणु मॉडल
जे जे थॉमसन (J. J. Thomson) ने 1898 में परमाणु का पहला मॉडल प्रस्तावित किया था। इसे तरबूज मॉडल (Watermelon model) या प्लम पुडिंग मॉडल (Plum Pudding model) भी कहा जाता है।
इस मॉडल के अनुसार:
- एक परमाणु के अंदर धनात्मक आवेश पूरे परमाणु में समान रूप से वितरित होता है।
- इलेक्ट्रॉन, जिन पर ऋणात्मक आवेश होता है, उसमें तरबूज के बीज की तरह ही अंतर्निहित होते हैं।
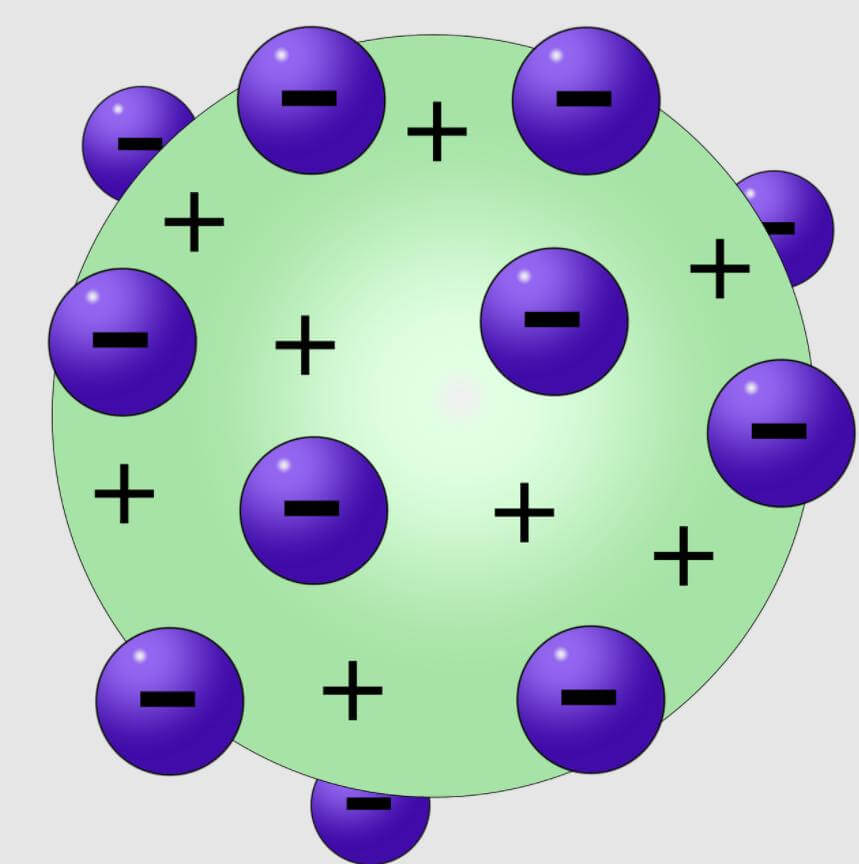
थॉमसन के परमाणु मॉडल की अस्वीकृति के कारण
इस मॉडल के पतन का मुख्य कारण यह था कि यह कुछ प्रयोगों के नतीजों की व्याख्या करने में सक्षम नहीं ही पाया था - विशेष रूप से अर्न्स्ट रदरफोर्ड, Ernst Rutherford (1871-1937) द्वारा किए गए प्रयोग (वे जे जे थॉमसन के पूर्व शोध छात्र थे)।
यह देखा गया कि जब हम तत्वों पर α-कणों की बौछार करते हैं, तो उनमें से अधिकांश गुजर जाते हैं लेकिन कुछ α-कण बहुत बड़े कोणों से विक्षेपित होते हैं। इसका मतलब है कि परमाणु के अंदर कुछ ऐसा है जो बहुत छोटा है लेकिन उसमें सभी धनात्मक आवेश केंद्रित हैं। अर्थार्थ, धनात्मक आवेश परमाणु के पूरे आयतन में समान रूप से बिखरा हुआ नहीं है, जैसा कि परमाणु के तरबूज मॉडल द्वारा सुझाया गया था।
 प्रयोग
प्रयोगErnst Rutherford के प्रयोगों का विवरण इस प्रकार है।
वह विभिन्न धात्विक फॉयल पर α-कणों की बौछार कर रहे थे। फिर वह रिकॉर्ड करते थे कि वे α-कण कहाँ गए - क्या वे रुक गए, क्या वे बस गुजर गए, या विक्षेपित हो गए?
यह सब परमाणु की संरचना के संबंध में नई अंतर्दृष्टि खोजने के लिए किया जा रहा था।
उनका अवलोकन निम्नलिखित था:
अधिकांश α-कण बिना विचलित हुए धात्विक पन्नी से होकर गुजर गए, जैसे कि वहां कुछ हो ही न। इससे पता चला कि अधिकांश परमाणु खोखला होता है। जे जे थॉमसन ने सुझाव दिया कि इसका मतलब है कि पूरा परमाणु सकारात्मक आवेश से भरा नहीं है।
लेकिन कुछ α-कण विचलित हो गए, कुछ बहुत बड़े कोण से। चूंकि α-कण धनात्मक आवेश वाले होते हैं, उनके विचलन का कारण किसी अन्य धनात्मक आवेशित इकाई के साथ मुठभेड़ रहा होगा, जिसने उन्हें मजबूत इलेक्ट्रोस्टैटिक प्रतिकर्षण के कारण दूर धकेल दिया होगा - इस प्रकार परमाणु के नाभिक की खोज की गई थी, और यह पता लगा की यह धनात्मक होता है|
इसलिए, जे. जे. थॉमसन द्वारा दिए गए मॉडल को खारिज करने के बाद, अर्न्स्ट रदरफोर्ड ने अपना एक मॉडल प्रस्तावित किया।
रटरफोर्ड का परमाणु मॉडल
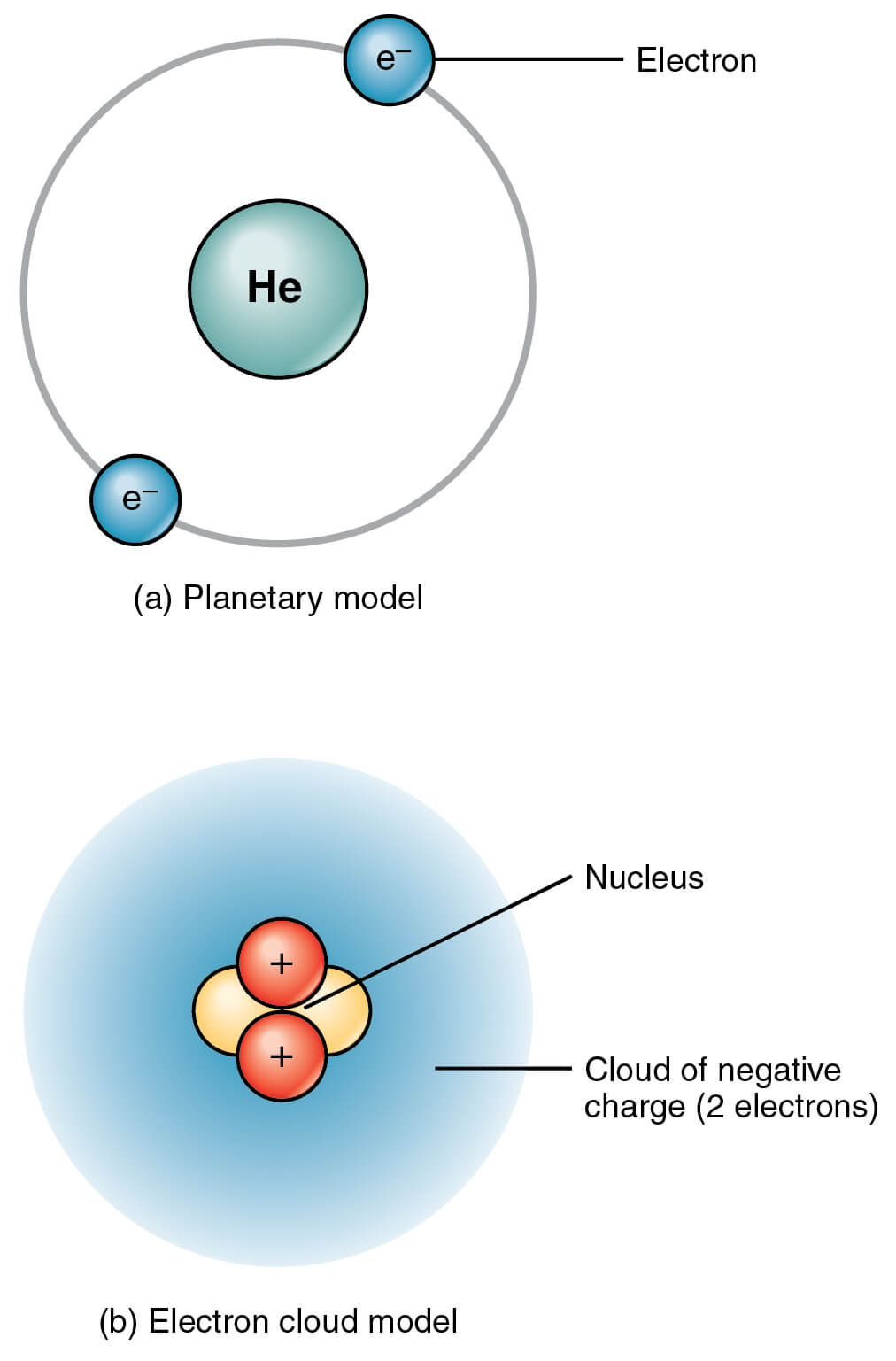
परमाणु की संरचना के लिए दूसरा और अधिक सफल मॉडल अर्न्स्ट रदरफोर्ड (1871-1937) द्वारा दिया गया था। इसे परमाणु का ग्रहीय मॉडल (Planetary model of atom) या परमाणु का नाभिकीय मॉडल (Nuclear model of atom) कहा जाता है।
वास्तव में, जैसा कि ऊपर उल्लेख किया गया है, यह उनका प्रयोग ही था जिसने साबित कर दिया कि थॉमसन का परमाणु मॉडल सही नहीं हो सकता।
इस मॉडल के अनुसार:
- परमाणु के केंद्र में एक छोटा, अत्यधिक घना और धनावेशित क्षेत्र होता है, जिसे नाभिक कहते हैं।
- नाभिक में सभी धनात्मक आवेश और परमाणु का लगभग सारा द्रव्यमान होता है।
- नाभिक, प्रोटॉन और न्यूट्रॉन से बना होता है।
- ऋणात्मक आवेशित इलेक्ट्रॉन धनावेशित नाभिक के चारों ओर वृत्ताकार कक्षाओं में बहुत तेज गति से चक्कर लगाते हैं। विभिन्न इलेक्ट्रॉनों की कक्षाओं के बीच बहुत अधिक स्थान होता है। अत: परमाणु का ज्यादातर भाग रिक्त स्थान होता है। यह हमारे सौर मंडल के समान है, जहां ग्रह सूर्य के चारों ओर चक्कर लगाते हैं - इसलिए इसका नाम “रदरफोर्ड का ग्रहीय मॉडल” पड़ा।
- हालांकि, ग्रहों और सूर्य के विपरीत, जो गुरुत्वाकर्षण के कारण एक-दूसरे की ओर आकर्षित होते हैं, ऋणात्मक रूप से आवेशित इलेक्ट्रॉन और धनात्मक आवेशित नाभिक उनके बीच इलेक्ट्रोस्टैटिक आकर्षण बल के माध्यम से जुड़े होते हैं। यह परमाणु को एक साथ बनाये रखता है।
रटरफोर्ड के परमाणु मॉडल की अस्वीकृति के कारण
यह मॉडल परमाणु की वर्तमान अवधारणा के बहुत करीब है। हालांकि इसमें कई कमियां थीं जिसके कारण अन्य वैज्ञानिकों ने इसे अस्वीकार कर दिया और आगे इसमें सुधार किया। आइए जानते हैं इसके रिजेक्शन के पीछे के कारण।
परमाणुओं की स्थिरता
रटरफोर्ड का परमाणु मॉडल परमाणुओं की स्थिरता की व्याख्या करने में सक्षम नहीं था।
रटरफोर्ड के परमाणु मॉडल के अनुसार, इलेक्ट्रॉन नाभिक के चारों ओर चक्कर लगा रहे हैं। अभिकेन्द्रीय बल के कारण ऐसे परिक्रामी इलेक्ट्रॉन नाभिक की ओर निरंतर गति करते रहेंगे।
अब, शास्त्रीय विद्युत चुम्बकीय सिद्धांत (classical electromagnetic theory) के अनुसार, कोई भी त्वरित आवेशित कण ऊर्जा को विकीर्ण करता है (और इस प्रकार ऊर्जा खोता रहता है)। तो, इन इलेक्ट्रॉनों को विद्युत चुम्बकीय तरंगों के रूप में ऊर्जा को लगातार विकीर्ण/उत्सर्जित करना चाहिए।
जैसे ही इलेक्ट्रॉन ऊर्जा खोते जाते हैं, वे धीमे होते जाते हैं। यह उन्हें नाभिक के और करीब ले जायेगा, जब तक अंततः वह इसमें गिर न जाये। परमाणु टूट जाएगा।
यदि ऐसा है, तो कोई भी परमाणु स्थिर नहीं होना चाहिए - ब्रह्मांड का अस्तित्व ही नहीं होना चाहिए। लेकिन हम निश्चित रूप से जानते हैं कि ऐसा नहीं है।
असतत तरंग दैर्ध्य की रोशनी का उत्सर्जन
रटरफोर्ड का परमाणु मॉडल यह समझाने में सक्षम नहीं था कि परमाणु केवल कुछ असतत तरंग दैर्ध्य (discrete wavelengths) के प्रकाश का उत्सर्जन क्यों करते हैं।
यदि इलेक्ट्रॉन ऊर्जा खोते जाते हैं और निरंतर आधार पर धीमे होते जाते हैं, तो उनकी कक्षा की त्रिज्या भी निरंतर आधार पर धीरे-धीरे कम होनी चाहिए। अतः रटरफोर्ड के परमाणु मॉडल के अनुसार एक इलेक्ट्रॉन नाभिक के चारों ओर सभी संभावित त्रिज्याओं की कक्षाओं में चक्कर लगा सकता है। इससे उन्हें सभी संभावित आवृत्तियों के निरंतर विकिरणों (continuous radiations of all possible frequencies) का उत्सर्जन करना चाहिए।
हालाँकि, यह प्रयोगों के माध्यम से देखा गया है कि परमाणु उत्सर्जित करते हैं:
- केवल कुछ निश्चित आवृत्तियों का विकिरण (सभी आवृत्तियों का नहीं)
- असतत रूप में (निरंतर रूप से नहीं)
ये कारण इस मॉडल को खारिज करने के लिए काफी थे।
 परमाणु स्पेक्ट्रा की अवधारणा
परमाणु स्पेक्ट्रा की अवधारणाजब हम किसी तत्व के परमाणुओं को उत्तेजित करते हैं, तो वे केवल कुछ विशिष्ट तरंग दैर्ध्य के विकिरण उत्सर्जित करते हैं। उत्सर्जित तरंग दैर्ध्य के इस सेट को उस तत्व का परमाणु स्पेक्ट्रम (Atomic Spectra या Atomic Spectrum) या उत्सर्जन रेखा स्पेक्ट्रम (Emission line spectrum) कहा जाता है।
क्या आप देखना चाहते हैं कि यह कैसा दिखता है?
यहाँ हाइड्रोजन परमाणु का उत्सर्जन रेखा स्पेक्ट्रम दर्शाया गया है:
हालांकि यह अलग-अलग तत्वों के लिए अलग-अलग होगा, पर अप्रशिक्षित आंखों के लिए यह समान दिखता है - एक गहरे रंग की पृष्ठभूमि पर कई चमकदार रंगीन रेखाएं।
यह स्पेक्ट्रम प्रत्येक तत्व के लिए अलग होता है और इसलिए इस स्पेक्ट्रम का विश्लेषण करके हम यह पता लगा सकते हैं कि हम किस तत्व को देख रहे हैं। उदाहरण के लिए, किसी तारे से आने वाले प्रकाश का विश्लेषण करके वैज्ञानिक बता सकते हैं कि उस तारे में किस प्रकार के तत्व मौजूद हैं।
तो, एक तत्व का परमाणु स्पेक्ट्रा फिंगरप्रिंट जैसा होता है। यह खोज उन्नीसवीं सदी की शुरुआत में की गई थी। वैज्ञानिकों ने निम्न दाब पर रखी परमाणु गैस या वाष्प को विद्युत धारा प्रवाहित करके उत्तेजित किया। उन्होंने पाया कि प्रत्येक तत्व विकिरण के एक विशिष्ट स्पेक्ट्रम से जुड़ा है।
परमाणुओं द्वारा विशिष्ट तरंग दैर्ध्य के उत्सर्जन से पता चलता है कि विकिरण का यह स्पेक्ट्रम किसी तरह परमाणु की आंतरिक संरचना से संबंधित है।
अवशोषण स्पेक्ट्रम की अवधारणा: जिस तरह हमारे पास किसी तत्व का उत्सर्जन लाइन स्पेक्ट्रम (Emission line spectrum) है, हमारे पास किसी तत्व का अवशोषण स्पेक्ट्रम (Absorption Spectrum) भी होता है। जब किसी तत्व की गैस के माध्यम से सफेद प्रकाश पारित किया जाता है, और फिर एक स्पेक्ट्रोमीटर (spectrometer) के माध्यम से प्रेषित प्रकाश देखा जाता है, तो हम पाते हैं कि स्पेक्ट्रम में कुछ अंधेरी रेखाएं हैं। यह उस तत्व का अवशोषण स्पेक्ट्रम है।
और आकर्षक तथ्य यह है कि, यह अवशोषण स्पेक्ट्रम, उत्सर्जन स्पेक्ट्रम पर बिल्कुल ओवरलैप करता है। अर्थात किसी तत्व के अवशोषण स्पेक्ट्रम में काली रेखाएं ठीक उसी स्थान पर होती हैं जहां उस विशेष तत्व के उत्सर्जन स्पेक्ट्रम में चमकीली रेखाएं (तरंगदैर्ध्य) थीं।
बोहर का परमाणु मॉडल
1913 में नील्स बोहर (Niels Bohr) द्वारा प्रस्तावित इस मॉडल को क्वांटम परमाणु मॉडल के रूप में भी जाना जाता है, क्योंकि यह पहला परमाणु मॉडल था जिसने क्वांटम भौतिकी के सिद्धांतों का उपयोग किया था।
 नोट
नोटक्वांटम भौतिकी उस समय बहुत नई थी और इसकी अवधारणाएं अभी भी बनाई जा रही थीं (हालांकि यह प्रक्रिया अभी भी जारी है)। इसलिए, बोहर के मॉडल को सही मायने में क्वांटम परमाणु मॉडल कहने के बजाय, परमाणु की संरचना का एक अर्ध-शास्त्रीय चित्र (semi-classical picture of the structure of atom) कहा जा सकता है।
नील्स बोहर ने रटरफोर्ड के परमाणु मॉडल की विफलता से समझा, कि उस समय के शास्त्रीय यांत्रिकी और विद्युत चुंबकत्व के स्थापित सिद्धांत परमाणु की तरह की क्वांटम स्तर की चीज़ों की संरचना की व्याख्या करने में सक्षम नहीं होंगे, या प्रयोगों के नतीजों की व्याख्या नहीं कर पाएंगे।
हालाँकि, वह कुछ हद तक रटरफोर्ड से सहमत थे, क्योंकि उन्होंने स्वीकार किया था कि:
- परमाणु, नाभिक और इलेक्ट्रान से मिलकर बना होता है।
- नाभिक, प्रोटॉन और न्यूट्रॉन से बना होता है। प्रोटॉन पर धनात्मक आवेश होता है, जबकि न्यूट्रॉन पर कोई आवेश नहीं होता। इस वजह से नाभिक धनात्मक रूप से आवेशित होता है।
- एक परमाणु में इलेक्ट्रॉनों की संख्या हमेशा प्रोटॉन की संख्या के बराबर होती है। चूँकि इलेक्ट्रान और प्रोटॉन में क्रमशः ऋणात्मक और धनात्मक आवेश समान होते हैं, इसलिए परमाणु विद्युत रूप से संपूर्ण रूप से आवेशहीन होता है।
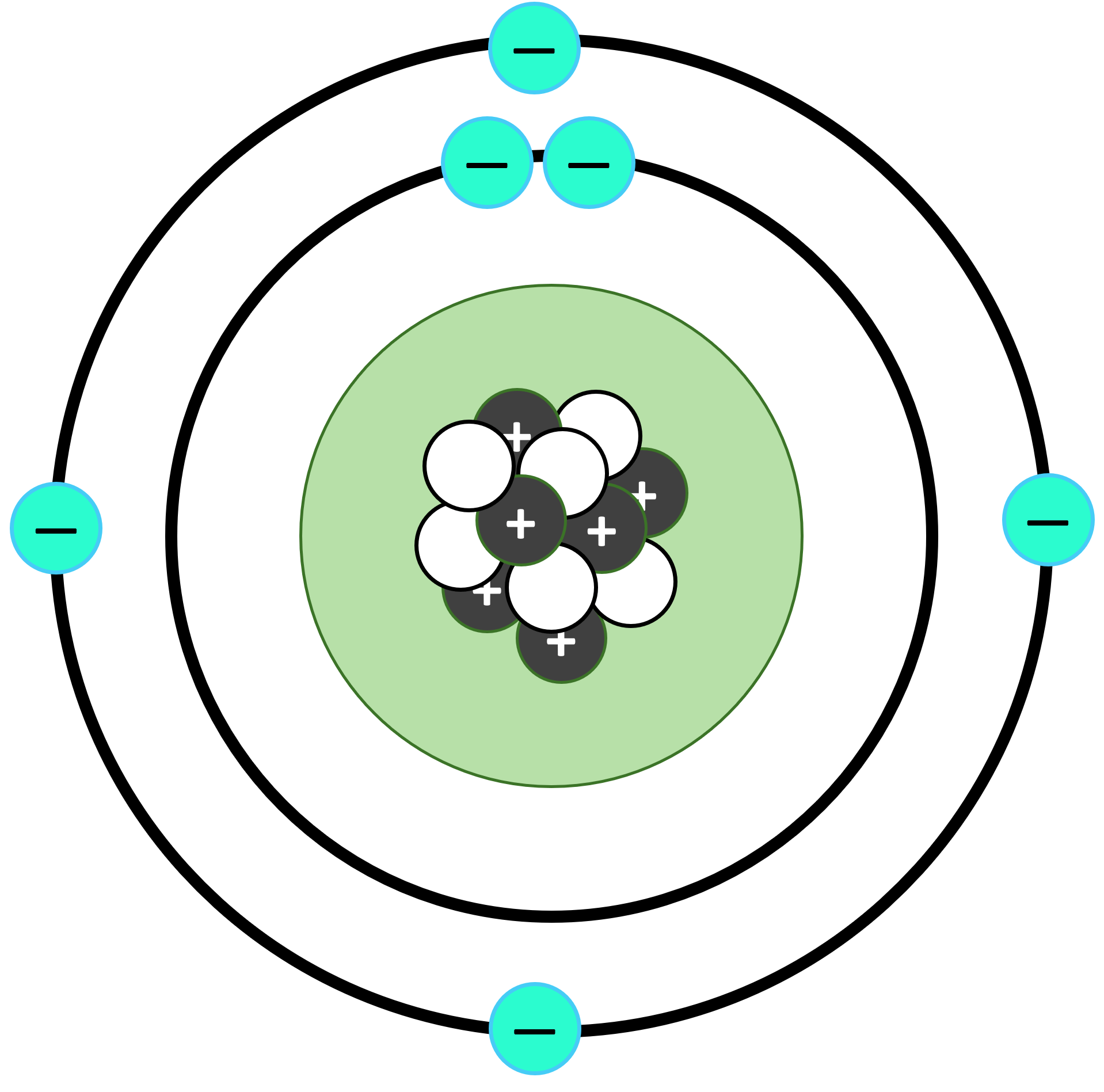
लेकिन फिर उन्होंने परमाणु की स्थिरता और असतत वर्णक्रमीय रेखाओं के उत्सर्जन की व्याख्या करने के लिए क्वांटम भौतिकी से कुछ नए विचार जोड़े।
उन्होंने अपना सिद्धांत तीन अभिधारणाओं के रूप में दिया। आइए एक-एक करके इनका अध्ययन करें।
बोहर की पहली अभिधारणा
बोहर की पहली अभिधारणा परमाणु की स्थिर कक्षाओं और स्थिर अवस्थाओं के संबंध में थी।
स्थिर कक्षाओं की अवधारणा: उनके अनुसार नाभिक के चारों ओर कुछ निश्चित कक्षाएँ या ऊर्जा स्तर होते हैं जो स्थिर होते हैं, अर्थात इलेक्ट्रॉन इन कक्षाओं में नाभिक के चारों ओर बिना किसी ऊर्जा का उत्सर्जन किए घूम सकते हैं। (यह उस समय प्रचलित विद्युत चुम्बकीय सिद्धांतों के खिलाफ था।)
परमाणु की स्थिर अवस्था की अवधारणा: यदि किसी परमाणु में इलेक्ट्रॉन इन कक्षाओं में हों तो वह परमाणु स्थिर रहेगा। तो, परमाणु की कुछ निश्चित स्थिर अवस्थाएँ (stable states, stationary states) होती हैं, और ऐसी प्रत्येक अवस्था के साथ कुछ निश्चित कुल ऊर्जा जुड़ी होती है।
 इलेक्ट्रॉनिक विन्यास (Electronic Configuration)
इलेक्ट्रॉनिक विन्यास (Electronic Configuration)अब, स्थिर कक्षाओं की अवधारणा को थोड़ा और विस्तार से समझते हैं।
इलेक्ट्रॉन नाभिक के चारों ओर विभिन्न स्थिर कक्षाओं में चक्कर लगाते हैं। प्रत्येक कक्षा में एक निश्चित ऊर्जा स्तर होता है और वे कुछ निश्चित अधिकतम इलेक्ट्रॉनों को ही धारण कर सकती हैं।
एक परमाणु के भीतर विभिन्न ऊर्जा स्तरों में इलेक्ट्रॉनों की इस व्यवस्था को इलेक्ट्रॉनिक विन्यास (Electronic Configuration) कहा जाता है।
इन कक्षाओं या कोशों को संख्या 1, 2, 3, 4, 5 और 6 या अक्षर K, L, M, N, O और P द्वारा निरूपित किया जाता है। एक कक्षा द्वारा धारण किए जा सकने वाले इलेक्ट्रॉनों की अधिकतम संख्या निम्न सूत्र द्वारा दी जा सकती है:
कक्षा में इलेक्ट्रॉनों की अधिकतम संख्या = 2n2, जहाँ n = कक्षा संख्या
अंतरतम कक्षा को 1 अंक दिया गया है या K अक्षर से दर्शाया जाता है। यह कक्षा, जो नाभिक के सबसे निकट है, उसमें न्यूनतम संभव ऊर्जा होती है। तो, यह अधिकतम 2 इलेक्ट्रॉनों को धारण कर सकती है।
अगली कक्षा की संख्या 2 है या इसे L अक्षर से दर्शाया जाता है। इसमें अधिकतम 8 इलेक्ट्रॉन हो सकते हैं।
अगली कक्षा की संख्या 3 है या इसे M अक्षर से दर्शाया जाता है। इसमें अधिकतम 18 इलेक्ट्रॉन हो सकते हैं।
अगली कक्षा की संख्या 4 है या इसे N अक्षर से दर्शाया जाता है। इसमें अधिकतम 32 इलेक्ट्रॉन हो सकते हैं।
और इसी तरह आगे भी।
उदाहरण के लिए, सोडियम (Na) में 11 प्रोटॉन और 11 इलेक्ट्रॉन होते हैं। तो, n = 11, और इसकी कक्षाएँ इस तरह दिखाई देंगी:
- K कक्षा: 2 इलेक्ट्रॉन
- L कक्षा: 8 इलेक्ट्रॉन
- M कक्षा: अंतिम शेष 1 इलेक्ट्रॉन (संयोजी इलेक्ट्रान, वैलेंस इलेक्ट्रॉन)
आइए एक और उदाहरण पर विचार करें। एल्युमिनियम (Al) में 13 प्रोटॉन और 13 इलेक्ट्रॉन होते हैं। तो, n = 13, और इसकी कक्षाएँ इस तरह दिखाई देंगी:
- K कक्षा: 2 इलेक्ट्रॉन
- L कक्षा: 8 इलेक्ट्रॉन
- M कक्षा: अंतिम शेष 3 इलेक्ट्रॉन (संयोजी इलेक्ट्रान, वैलेंस इलेक्ट्रॉन)
बोहर की दूसरी अभिधारणा
बोहर की दूसरी अभिधारणा नाभिक के चारों ओर इलेक्ट्रॉनों की इन स्थिर कक्षाओं के ऊर्जा स्तरों के संबंध में थी।
प्रत्येक स्थिर कक्षा, एक निश्चित मात्रा की ऊर्जा से जुड़ी होती है। इलेक्ट्रॉन केवल उन्हीं कक्षाओं में पाए जाते हैं जिनमें कोणीय संवेग (angular momentum) h/2π का कोई अभिन्न गुणज होता है, जहां h प्लैंक स्थिरांक (= 6.6 × 10-34 J s) होता है।
कक्षा का कोणीय संवेग = n (h/2π), जहाँ n = 1, 2, 3,….
तो, परिक्रमा करने वाले इलेक्ट्रॉन का कोणीय संवेग परिमाणित होता है।
- अंतरतम कक्षा में n = 1 है, और इसलिए इसका कोणीय संवेग h/2π है, अर्थात निम्नतम।
- अगली कक्षा में n = 2 है, और इसलिए इसका कोणीय संवेग 2h/2π = h/π है।
- और इसी तरह आगे भी।
जाहिर है, सबसे बाहरी कक्षा में अधिकतम ऊर्जा होगी।
बोहर की तीसरी अभिधारणा
बोहर की तीसरी अभिधारणा इलेक्ट्रॉनों के ऊर्जा स्तरों में ऊर्जा परिवर्तन के संबंध में थी। हम पहले से ही जानते हैं कि स्थिर कक्षा में इलेक्ट्रॉन न तो ऊर्जा खोता है और न ही प्राप्त करता है। हालांकि, अगर यह एक कक्षा से दूसरी कक्षा में कूदता है, तो इसकी ऊर्जा बदल जाती है।
उदाहरण के लिए, यदि कोई इलेक्ट्रॉन बाहरी उच्च ऊर्जा कक्षा से आंतरिक निम्न ऊर्जा कक्षा में कूदता है, तो वह एक फोटॉन उत्सर्जित करेगा। उस फोटॉन की ऊर्जा उन दो कक्षाओं के बीच ऊर्जा अंतर के बराबर होगी।
हम इसे एक समीकरण का उपयोग करके निरूपित कर सकते हैं।
उत्सर्जित फोटॉन की आवृत्ति, hν = Ei – Ef
जहां Ei प्रारंभिक बाहरी कक्षा की ऊर्जा है, और Ef अंतिम आंतरिक कक्षा की ऊर्जा है
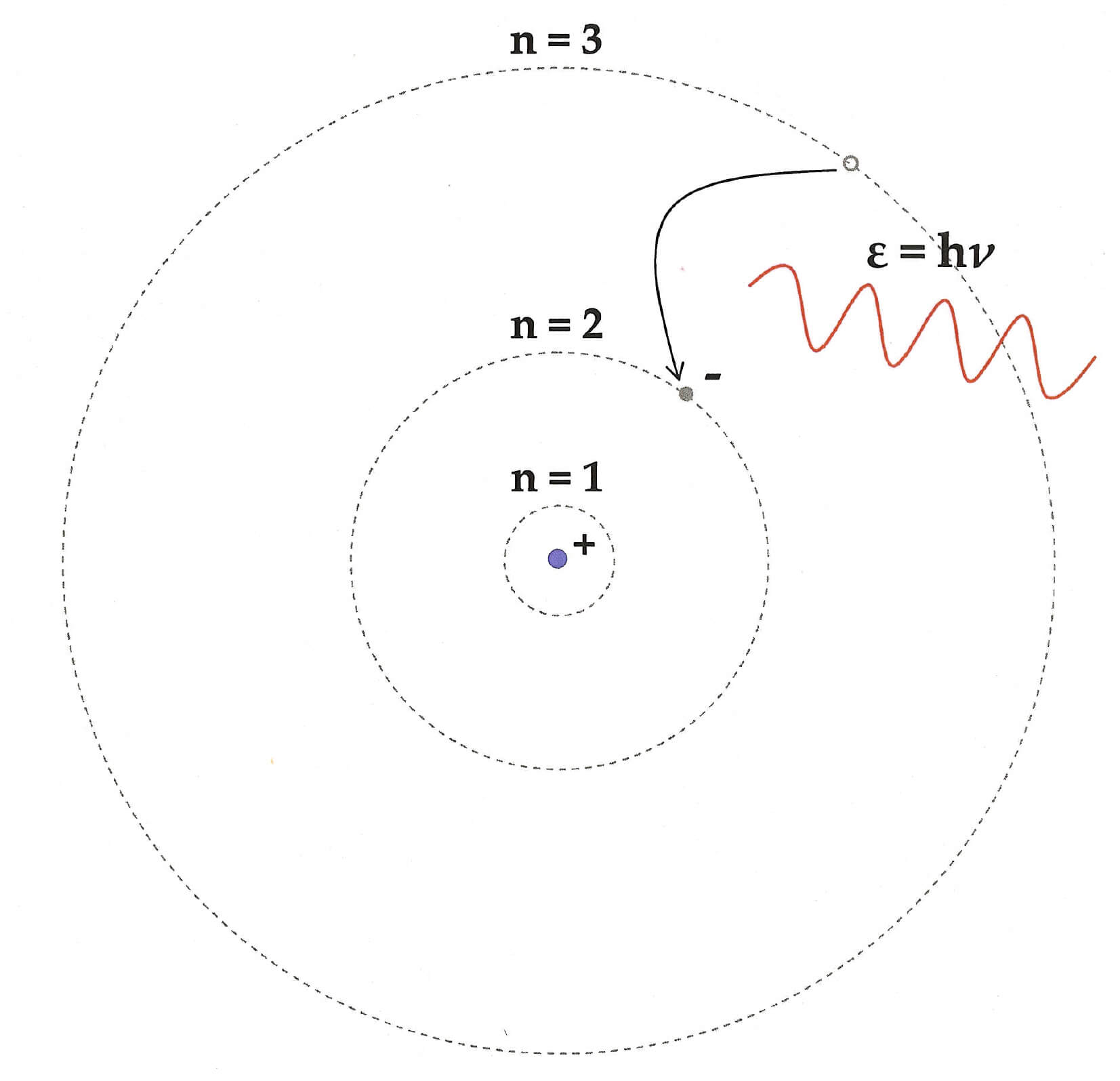
 नोट
नोटबोहर की तीसरी अभिधारणा, प्लैंक और आइंस्टीन द्वारा विकसित क्वांटम अवधारणाओं से प्रेरित थी।
बोहर के परमाणु मॉडल के खिलाफ आपत्ति
- उनके द्वारा की गई धारणाएं पूरी तरह से मनमानी थीं। यह ऐसा था मानो उसका एकमात्र लक्ष्य प्रायोगिक नतीजों को सही ठहराना था।
- यह वर्णक्रमीय रेखाओं की तीव्रता (intensity of the spectral lines) और वर्णक्रमीय रेखाओं की महीन संरचना (fine structure of spectral lines) की व्याख्या नहीं कर सका।
- यह सिद्धांत केवल एक-इलेक्ट्रॉन वाले परमाणुओं/आयनों के लिए मान्य था। इसे कई इलेक्ट्रॉनों वाले जटिल परमाणुओं पर लागू नहीं किया जा सकता था, अर्थात इस सिद्धांत को सामान्यीकृत नहीं किया जा सकता था। यह जटिल परमाणुओं द्वारा निर्मित स्पेक्ट्रा की उचित व्याख्या प्रदान करने में विफल रहा।
इन कमियों को पूरा करने के लिए क्वांटम यांत्रिकी मॉडल (Quantum Mechanics Model) नामक एक नया सिद्धांत प्रस्तावित किया गया था, जो (जैसा कि नाम से पता चलता है) क्वांटम यांत्रिकी पर आधारित था।
क्वांटम यांत्रिकी मॉडल (Quantum Mechanics Model)
यह मॉडल काफी हद तक बोहर के मॉडल के समान है, पर एक बड़ा अंतर है - यहाँ, इलेक्ट्रॉन कुछ निश्चित कक्षाओं तक ही सीमित नहीं हैं।
वे नाभिक के चारों ओर एक संभाव्यता बादल (probability cloud) के रूप में रहते हैं। अर्थात्, एक निश्चित समय पर इलेक्ट्रॉनों की स्थिति (position) और संवेग (momentum) दोनों की भविष्यवाणी करना असंभव है। इसलिए इसे इलेक्ट्रॉन क्लाउड मॉडल (Electron Cloud Model) भी कहा जाता है।
 कक्षीय की अवधारणा (Concept of Orbital)
कक्षीय की अवधारणा (Concept of Orbital)क्वांटम भौतिकी हमें बताती है कि इलेक्ट्रॉनों जैसे क्वांटम कणों में कण और तरंग दोनों के गुण होते हैं (इसे दोहरा गुण, dual properties कहा जाता है)। श्रोडिंगर तरंग समीकरण (Schrödinger wave equation) परमाणु में इलेक्ट्रॉनों को एक तरंग जैसा विवरण प्रदान करता है।
तरंगों के रूप में, इलेक्ट्रॉन नाभिक के चारों ओर एक निश्चित क्षेत्र में कहीं भी हो सकते हैं। वह इलेक्ट्रॉन वास्तव में कहां हो सकता है यह संभावना का विषय है। (बोहर मॉडल में इलेक्ट्रॉनों की कण प्रकृति के विपरीत, जिसमें इलेक्ट्रॉन निश्चित गोलाकार कक्षाओं में नाभिक के चारों ओर परिक्रमा करते हैं)
इस प्रायिकता (probability) का पता लगाने के लिए हम ऑर्बिटल (Orbital) का उपयोग करते हैं, जो कि एक-इलेक्ट्रॉन तरंग फलन (one-electron wave function) है। यह फलन केवल इलेक्ट्रॉन के निर्देशांकों पर निर्भर करता है।
हालाँकि, कक्षीय (Orbital) की अवधारणा बोहर की निश्चित कक्षाओं (Orbits) की अवधारणा से बिल्कुल अलग है। ऑर्बिटल इलेक्ट्रॉनों की तरंग प्रकृति से संबंधित एक अवधारणा है, जबकि ऑर्बिट इलेक्ट्रॉन की कण प्रकृति से संबंधित एक अवधारणा थी।
परमाणु की संरचना के इस मॉडल को वर्तमान में परमाणु का सबसे सटीक निरूपण माना जाता है।
खैर, यह विडंबना है कि हमने थॉमसन के परमाणु मॉडल के साथ परमाणु की संरचना को समझने की इस यात्रा की शुरुआत की, जो परमाणु को एक घनात्मक आवेश तरबूज में जड़े गए इलेक्ट्रॉनों के रूप में मानता था। और अब हम परमाणु को ऋणात्मक रूप से आवेशित इलेक्ट्रॉनों का एक बादल मानते हैं, जिसके केंद्र में एक धनात्मक आवेशित नाभिक जड़ा होता है।
 वेक्टर मॉडल (Vector Model)
वेक्टर मॉडल (Vector Model)वेक्टर मॉडल भी बोहर के परमाणु मॉडल की कमियों को कवर करने के लिए प्रस्तावित एक मॉडल था। इसे रदरफोर्ड-बोहर परमाणु मॉडल को बहु-इलेक्ट्रॉन परमाणुओं पर लागू करने के प्रयास के रूप में जाना जाता है।
यह कोणीय गति (angular momentum) के संदर्भ में परमाणु का मॉडल है।